2021年9月15日
ISO/TC 276国内委員会
国際標準化機構(ISO)において、FIRM会員が多数参画し日米共同で開発した「細胞治療製品の試験と特性解析」に関する国際規格が発行されました。本国際規格には、細胞治療製品の品質を評価するための分析方法の設計、妥当性確認、試験などについて、「守るべきこと」「考慮すべきこと」が記述されています。今後、本国際規格が細胞治療製品の開発・製造に活用されることで、患者様に対して有効かつ安全な再生医療が提供されることが期待されます。
1.背景
再生医療は、重症のやけどや心不全・交通事故などによる脊髄損傷・ある種の白血病など、これまで治療が難しかった病気を治せる最先端の技術です。その再生医療を安心して受けられるようにするためには、体内に入れる「細胞治療製品」が安全で病気に効くことを確かめなければなりません。また、細胞治療製品だけでなく、その原料や製造途中の品質を守ることも大切です。これらの課題に対し、細胞治療製品の分析方法を確立しなければなりません。
細胞治療製品に用いる細胞は生きているため、常に分裂・成熟・老化して状態が変化します。さらに困ったことに、細胞は壊れやすいため、品質試験前の処理が悪いと結果が変わってしまいます。しかし、それら細胞特有の難しさに対応する「細胞治療製品の試験と特性解析」を進めるためのガイドラインはありませんでした。そのため、細胞治療製品の開発の遅さ、価格の高騰といった問題も起きていました。
2.規格の概要
今回発行された国際規格ISO 23033:2021(細胞治療製品の試験と特性解析)には、細胞治療製品の品質を測定・評価する方法を決めるための一般的な考え方、および、細胞治療製品の品質チェックリストを決めるために考慮すべき事が書かれています。
主な内容は以下の通りです。
・目的に合った細胞治療製品の品質特性評価試験のデザイン
– 細胞に求められる要件に基づいた測定法の選択
– 適切に測定するための機器・試薬等の要件
– 測定結果のバラつきを抑えるための注意事項
・分析方法が適切であることを継続的に検証する方法
・細胞治療製品の試験方法の決定
・試験記録の作成と結果報告
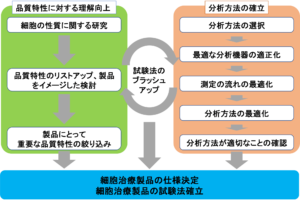
図1 細胞治療製品の試験法確立に向けた戦略
細胞の試験に関する規格は、2015年よりISO/TC 276(バイオテクノロジー)/WG 3(分析方法)において、日米がそれぞれ開発を進めてきましたが、2019年6月に共同開発に合意しました。国内審議委員会のメンバーが中心となり米国などと継続的に議論・調整を重ねた結果、2021年8月27日に国際規格が発行されました。
3.期待される効果
細胞治療製品を作るためには、変化しやすく壊れやすい細胞を長い時間かけて培養する必要があります。よって、患者様に最適な再生医療を提供するためには、その原料や製造途中経過もしっかりとモニタリング可能な、最適な分析が必要ですが、その方法を決めることは容易ではありません。本規格は、細胞治療製品の試験法決定を容易にすることで、速やかに、安定した細胞治療製品製造体制を確立することに貢献します(図2)。その結果、患者様への有効かつ安全な再生医療の提供を促進します。
 図2 本規格に基づく製造体制の安定化
図2 本規格に基づく製造体制の安定化
なお、国際規格は有料出版物として販売されております。必要な場合、下記ISOのホームページからのご購入が可能です。
https://www.iso.org/standard/74367.html?browse=tc
以上


