更新履歴
運営方針・役割
ミッション
安確法下における再生医療の健全な普及に向けて、特定細胞加工物を用いた研究活動や患者への治療行為に関係する再生医療に関し、特定細胞加工物製造事業者(届出/許可/認定施設)のあるべき姿、再生医療提供医療機関の課題、及び患者様への情報提供等について、討議し問題解決に寄与する。
活動方針
特定細胞加工物製造事業者が抱える様々な課題を抽出し、政策誘導も含め、FIRM内および関係機関(日本再生医療学会、疾患別学会、厚生労働省、PMDA等)との議論を通じて、働きかけを行う。
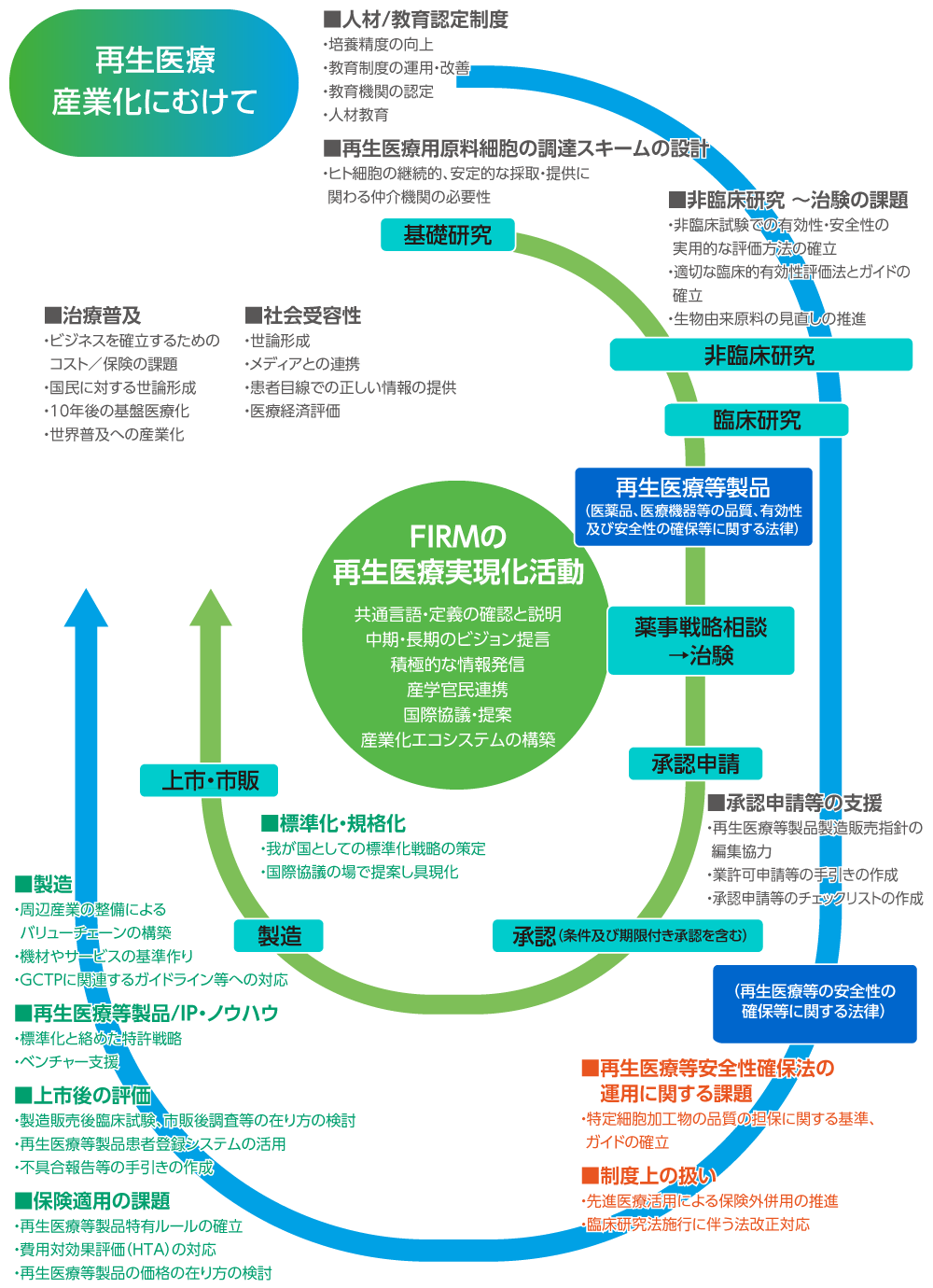
再生医療等安全性確保法の運用に関する課題
- 特定細胞加工物の品質の担保に関する基準、ガイドの確立
制度上の扱い
- 先進医療活用による保険外併用の推進
- 臨床研究法施行に伴う法改正対応
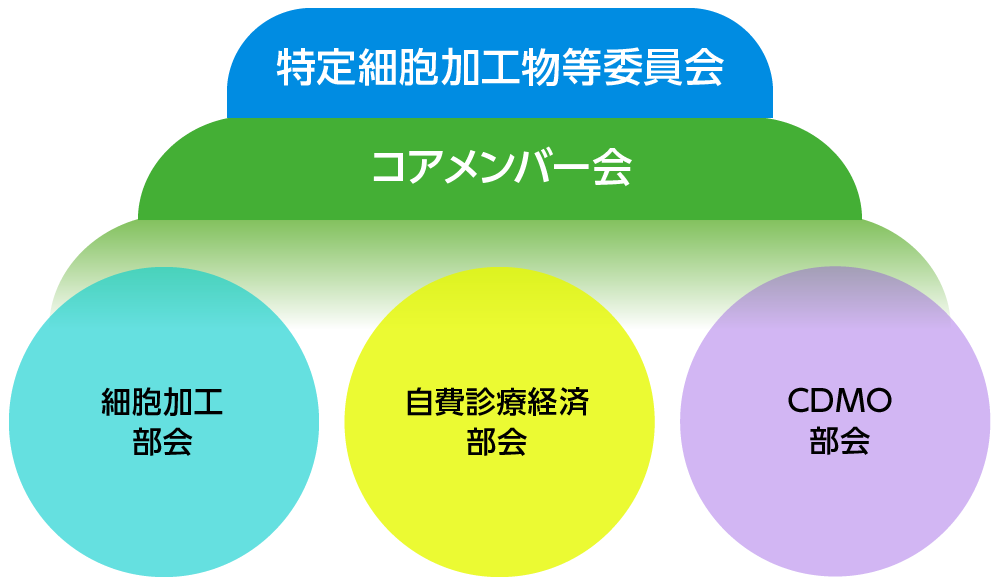
課題解決に向けた部会の立ち上げ
- 細胞加工部会
- 自費診療経済部会
- CDMO部会
組織
活動計画【2022年度】
- 特定細胞加工物製造事業者の届出、認定、許可それぞれのカテゴリー間のレベル感の差異のみならずカテゴリー内の機関ごとの差異という視点で現状分析を実施し、改善方針の意見の取りまとめを実施する。さらには日本再生医療学会や行政当局と意見交換を開始する。
- 混合診療禁止の背景の理解や保険外併用療養費制度の勉強会の実施。医薬品、医療機器に関する保険制度および薬価・償還価格の制度等の理解を深める活動の実施(例えば、勉強会等の開催)。保険外併用療養への安確法下の再生医療をどう位置付けるかの意見交換や意見集約のステップに着手。日本再生医療学会との意見交換も並行して実施。また、民間の医療保険の利活用に関する理解を深めるための活動を実施。
- 臨床研究および実臨床データを承認申請に使えるレベルにするための諸条件の理解と患者レジストリーに関する理解を深める勉強会等の実施。
- 市場動向、将来技術動向など必要に応じて市場調査を実施し、現状認識を深める。その上で対象とする技術や製品サービスの特定化とその課題および解決の方向性の検討を実施。対象とする技術や製品サービスの特定化とその課題および解決の方向性の検討を実施。さらには日本再生医療学会や行政当局との意見交換を実施。
- 保険収載への制度に関する勉強会の実施。
- FIRMマークを利用したサポインメンバー企業による製品サービスの認証化ステップへの支援協力実施。
細胞加工部会の活動趣旨
安確法下の再生医療に関する製造について、特定細胞加工物製造事業者の中で届出機関、認定機関、許可機関の間での製造に伴うハード面、ソフト面などに加え、運用全般も含む質の標準化を図り、製造全般の均質化が実現する。
自費診療経済部会の活動趣旨
安確法下の再生医療に関する製造以外の普及上の課題として、医療機関で提供される再生医療に関して、保険外併用(混合診療禁止の適用除外)を可能にし、患者の利便性を向上させる。
CDMO部会の活動趣旨
薬機法および安確法下における再生医療製造に関する特長および
課題を抽出し、FIRM内及び関係機関との議論を通じて、
日本のCDMO事業者の競争力強化と再生医療の産業化加速に貢献する。
活動実績
CDMOリストを公開致しました
下記の「再生医療等製品CDMO企業リスト」を経済産業省のご協力のもと4月1日に公開致しました。
再生・細胞医療・遺伝子治療分野は、iPS細胞分野等、我が国に優れた研究成果があり、将来の市場拡大が大きく期待されている分野です。一方で、産業化に向けては複雑な製造技術が必要である点が大きな課題となっており、創薬ベンチャー企業が初期の創薬開発を担うとともに、製造開発はCDMOに委託する水平分業が一般的となっています。この再生・細胞医療・遺伝子治療分野において、創薬開発の主体となるアカデミアや創薬ベンチャーと製造プロセス開発を行う受託開発・製造事業者(CDMO)のマッチングを促進することを目的とし、経済産業省の協力のもと、再生医療等製品CDMO企業リストを以下の通り作成、公表しました。
再生医療等製品CDMO企業リストの内容
本リストは、国内に法人登記があり、国内に製造施設があるCDMO企業(細胞・exvivo遺伝子治療、ウイルスベクター、プラスミド、mRNA)のうち、
①「再生医療等製品製造許可あるいは特定細胞加工物製造許可のいずれかを取得しているCDMO企業」
②「再生医療等製品製造許可あるいは特定細胞加工物許可のいずれかを取得しているCDMO企業との製造に関する連携について公表しているCDMO企業」
について、FIRMが公表情報から特定した各社に対し、委託を受けた調査会社がアンケートを実施し、収集した情報をまとめています。
(調査時期:2024年12月~2025年2月)
ページタイトル:“「再生医療等製品CDMO企業リスト」”
以下より閲覧可能:https://firm.or.jp/cdmo
勉強会の開催
他FIRM活動との協働
調査レポート
欧米では承認されている再生医療等製品が日本国内で開発されていない、または承認申請がなされないドラッグラグ・ロスは大きな社会問題となっています。Alliance for Regenerative Medicine(ARM)と再生医療イノベーションフォーラム(FIRM)は、必要な医療を日本の患者にスムーズに届けるために、欧米と日本の間の再生医療等製品に関する開発・製造・商業化の障壁を理解するための調査を行いました。
以下のリンクに調査結果レポート(英文)が掲載されています。
レポートタイトル:“Perspectives on Cell & Gene Therapy Development, Manufacturing, and Commercialization In Japan“
下記リンクより閲覧可能: https://alliancerm.org/cgt-development-japan/
参考和訳「日本における細胞・遺伝子治療の開発、製造、商業化に関する見解」はこちらからご覧ください。
再生医療等製品の海外展開(米国、欧州)に向けた調査報告の公開
特定細胞加工物等委員会 臨床研究・開発促進タスクフォースの皆さんが協力し、実施した『再生医療等製品の海外展開(米国、欧州)に向けた調査報告』が公開されました。
報告書はAMED HPをご確認ください。
AMED HP(再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生・細胞医療・遺伝子治療産業化促進事業) | 国立研究開発法人日本医療研究開発機構)より、
再生医療等製品の海外展開(米国、欧州)に向けた調査報告:
創薬ベンチャー企業等が海外展開(米国、欧州)を目指すにあたり、当該国・地域の規制要件に関する情報不足が一つの課題となっています。その結果、米国食品医薬品局(Food and Drug Administration:FDA)や欧州医薬品庁(European Medicines Agency:EMA)から、製造方法や品質規格の再設定、非臨床試験および臨床試験の再実施を求められ、これらの対応に伴い開発資金が不足する、開発期間の遅延する、といった問題が生じています。こうした状況により、創薬ベンチャー企業等が海外展開に踏み出せず、再生医療等製品の産業化における大きな障壁の一つとなっています。
本調査では、再生医療等製品の開発に関連する各規制当局(日本、米国、欧州)における治験届、承認申請、相談業務、実用化促進制度について調査を行いました。あわせて、創薬企業ベンチャー等が海外展開(米国、欧州)にあたり重要と考える情報についてのニーズ調査も実施しました。
(報告書) PDF(こちらリンクよりダウンロードください)


